コンドロイチン硫酸の硫酸化構造変化による骨硬化症の発症

小池 敏靖助教
Carbohydrate Research JSCR42 Poster Award(2023年9月9日付)
タイトル:Altered sulfation status of chondroitin sulfate is associated with osteosclerotic bone dysplasia
コンドロイチン硫酸の硫酸化構造変化による骨硬化症の発症
コンドロイチン硫酸は、N-アセチルガラクトサミンとグルクロン酸の二糖が繰り返し結合した直鎖状の糖鎖で、様々なパターンで硫酸化されます。この硫酸化糖鎖は、受容体などのタンパク質と相互作用することから、コンドロイチン硫酸鎖の生合成異常は疾患発症の一因となります。本研究では、致死性の骨硬化症であるRaine(レイン)症候群の原因遺伝子であるFAM20Cが、コンドロイチン硫酸鎖の硫酸化バランスを制御し、その異常によって骨硬化様症状が生じることを明らかにしました。この成果によりCarbohydrate Research JSCR42 Poster Award (2023年9月9日付) を受賞いたしました。本研究は、鳥取大学農学部の田村純一教授との共同研究となります。
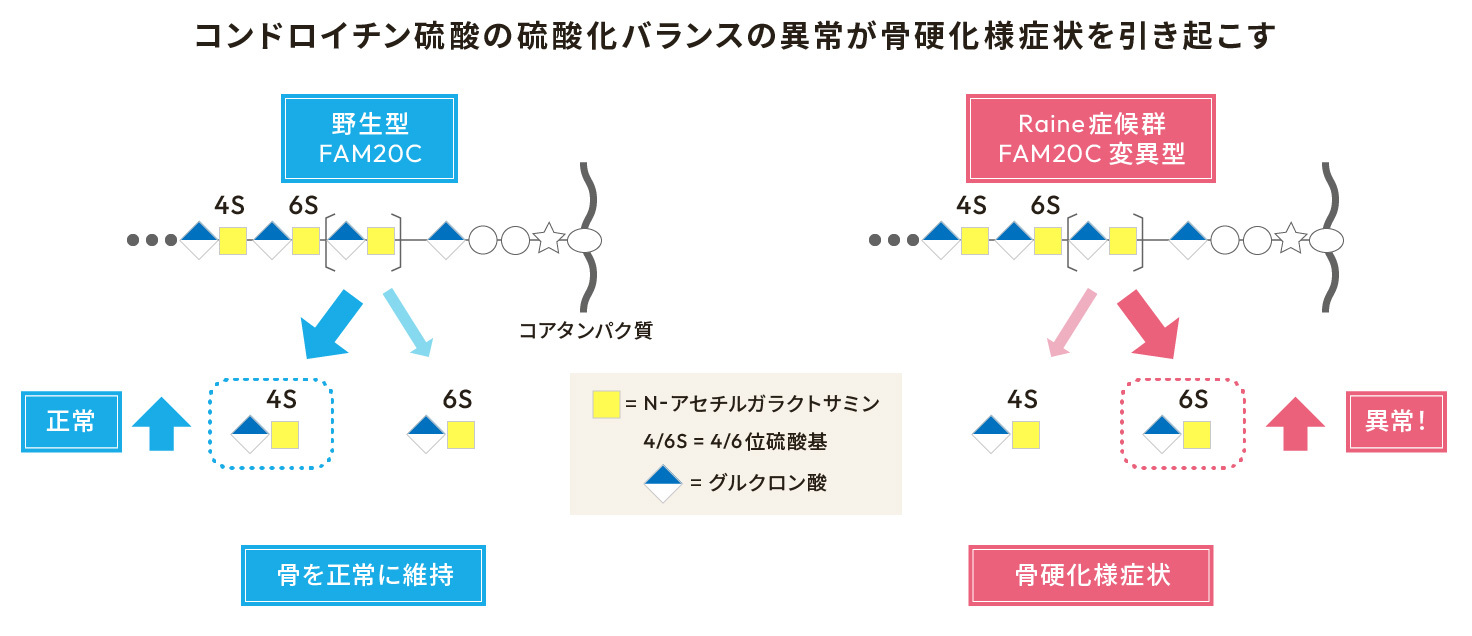
これまでに私たちは、FAM20Cのファミリー分子であるFAM20Bが、コンドロイチン硫酸鎖の生合成を制御することを明らかにしていました。今回FAM20Cの機能解析を進めたところ、FAM20CはN-アセチルガラクトサミン残基の4位を硫酸化するコンドロイチン4-O-硫酸基転移酵素(C4ST-1)と相互作用し、酵素活性を増加させることが明らかになりました。さらに興味深いことに、Raine症候群で見られるFAM20C変異型では、その作用が完全に失われていました。コンドロイチン硫酸鎖は、N-アセチルガラクトサミン残基の4位あるいは6位の硫酸化による4S/6S比で、硫酸化状態を評価することができます。そこで、FAM20C変異型をヒトの骨芽細胞様細胞株に導入したところ、4S/6S比が顕著に低下し、骨形成を示す石灰化が亢進しました。さらに、4S/6S比の低下を表現型に持つ遺伝子改変マウスを解析したところ、骨硬化が生じていました。そのため、FAM20Cの変異によるコンドロイチン硫酸鎖の硫酸化バランスの破綻が、骨硬化症発症の一因であると考えられます。今後は、この成果を骨疾患の治療や予防につなげるとともに、体に広く存在するコンドロイチン硫酸鎖の異常が、骨以外でも疾患発症に関与するかを解明していきたいと考えています。
同じカテゴリの研究レポート

-
コンドロイチン硫酸AはWnt3a/β-カテニン依存的なp53の発現亢進を介して骨芽細胞分化を抑制する


-
ワンポット立体選択的環化反応を基盤とする生物活性多官能複素環の実践的合成


-
免疫療法への応用を目指したプロバイオティクス由来細胞外小胞の有用性評価と機能改変技術の開発


-
がん固有の環境を標的とした癌治療増感をめざす創薬化学研究


-
高感度な免疫測定法の構築に必須な高親和力抗体を効率よく獲得する手法の開発


-
ラジカル化合物の反応性制御と生体計測プローブ・治療化合物への展開


-
磁性リポソームを利用した標的組織内滞留型磁性化間葉系幹細胞の作製


-
亜鉛触媒反応を応用した細胞内亜鉛イオンの高感度検出プローブの開発


-
医薬品合成を指向した基質設計とカチオン性ヨウ素試薬を鍵とする複素環合成法の開発


-
胆汁酸毒性低減を指向する肝細胞膜リン脂質トランスポーター活性化因子の探索
