
抗体を分析試薬として活用する抗原 (標的物質) の超微量定量分析法は、免疫測定法 (イムノアッセイ) と総称され、臨床検査、食品の衛生管理や環境の保全に不可欠な方法論となっています。その性能 (分析能) は、用いる抗体の良否に支配されます。標的抗原への親和性が大きいほど高感度な測定が可能になり、分子認識力 (特異性) が大きいほど夾雑物の影響を受けにくい測定が可能になります。しかし、このような測定を可能とする高性能抗体の作製は容易ではありません。我々は、免疫抗原の適切なデザイン・合成を基軸として、様々な生理活性物質 (ステロイド類、甲状腺ホルモン、環境汚染物質、規制薬物など) に対するモノクローナル抗体を (図1)を新規に調製し、実用的な免疫測定法を開発してきました。これらの抗体を産生するハイブリドーマ細胞は、後述する抗体工学的研究を可能とするキーマテリアルでもあり、研究室の大切な財産でした。
図1. モノクローナル抗体を新規調製した標的化合物の例
免疫測定法の感度は用いる抗体の測定対象化合物への親和力に支配され、親和力が高いほど高感度な測定が可能になります。しかし、一般に、抗原の分子量が小さくなるほど親和力の高い抗体の産生は困難になります。そこで、測定対象の低分子化合物に化学的な誘導化を施して分子量を高めることにより親和力の高い抗体を作製し、これを用いて誘導体を「測定対象の代理分子として」定量する誘導体化ELISAを試みました。
幻覚性キノコの薬理活性成分であるシロシン (Psi; 分子量204.27) は麻薬及び向精神薬取締法により規制を受けますが、親和力に優れる抗体の作製が困難でした。そこで、そのフェノール性ヒドロキシ基をtert-butyldimethylsilyl (TBS) 化した誘導体 (TBS/Psi; 分子量318.53) (図2A①) を定量するELISAを開発しました。TBS/Psi に対する特異モノクローナル抗体 (mAb-TBS/Psi) を作製したところ、期待どおり、先に作製したPsiそのものに対するモノクロ―ナル抗体 (mAb-Psi) に比べて69倍大きなKaを示しました。結果として、mAb-TBS/PsiによるTBS/PsiのELISAは、mAb-PsiによるPsiのELISAに比べて約100倍高感度でした (50%阻害値の比較による; 図2A②)。実際の測定では、キノコ抽出物にTBS triflate を室温で30分間反応させたのち、反応液をELISAに付します。幻覚性キノコ (マジックマッシュルーム) の代表例であるミナミシビレタケは強い陽性反応を示しましたが、食用キノコのシイタケ、マイタケ、キクラゲ、マッシュルーム (ツクリタケ) は陰性でした。
覚せい剤として厳しく規制されるメタンフェタミン (MAP) とアンフェタミン (AP) は、分子量が小さいうえ分子構造を特徴づける官能基に乏しいため (MAPではメチルアミノ基、APではアミノ基のみ)、高親和力抗体の産生が極めて困難でした。そこで、Teoc [2-(trimethylsilyl)ethoxycarbonyl] 基を付加して分子量の増大を図ったところ (図2B①)、上記の官能基の違いをマスクする効果も相俟って、Teoc化したMAPとAPに同等かつ高感度に反応するモノクロ―ナル抗体が得られました。この抗体を用いることにより、ごく微量の被疑物質 (~100 μg) について、MAPまたはAP含有の有無を短時間で判定する「誘導体化イムノクロマト法」が可能となりました (図2B②)。被検物質にTeoc-O-succinimidylを室温で30分間反応させたのち、反応液をクロマトデバイスに点着します。この成果を発表した論文は、Analytical Methods誌の「HOT Articles」に選ばれています。
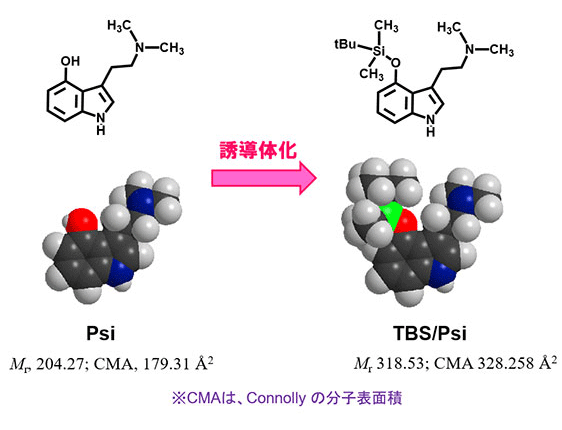
図2A①. シロシン(Psi)のTBS誘導体化
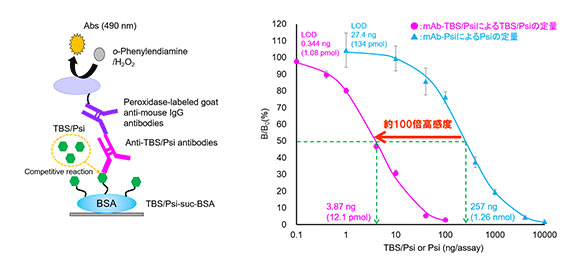
図2A②. TBS/PsiおよびPsiのELISA ―原理(左)と用量作用曲線(右)―
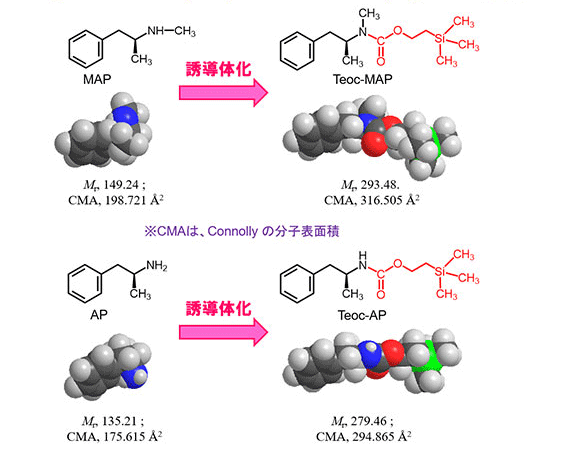
図2B①. メタンフェタミン(MAP)およびアンフェタミン(AP)のTeoc誘導体化

図2B②. メタンフェタミン(MAP)およびアンフェタミン(AP)の誘導体化イムノクロマト法
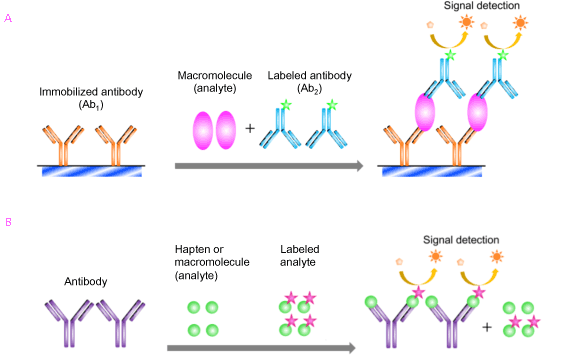
免疫測定法の原理は、競合型と非競合型に大別されます(図3)。タンパク質の超高感度定量法として多用されている 「サンドイッチアッセイ」 は非競合型の代表的な例で (図3A)、測定対象の抗原を2種類の抗体 (固定化抗体と標識抗体) でサンドイッチするように反応させるものです。競合型 (図3B) にくらべて高い感度が容易に得られ、特異性や精度にも優れるアッセイ原理ですが、 低分子抗原 (ハプテン) には適用することが困難です。
図3. 非競合型免疫測定法 (サンドイッチアッセイ) (A) と競合型免疫測定法 (B) の原理
我々は、抗イディオタイプ抗体 (抗体の可変部を認識する「第2抗体」) や免疫複合体に特異的な抗体をキー試薬とする低分子生理活性物質の非競合型システムの開発を検討しています。図4Aに示すアッセイ系により、20 attomole (2×10−17mol) の副腎皮質ステロイドを検出することができました(図4B)。これは、従来の競合法によるステロイドの免疫測定法より1000倍以上高い感度と言えます。
図4. 副腎皮質ステロイドの非競合型酵素免疫測定法 (immunoenzymometric assay) 測定原理 (A) と用量作用曲線 (B)
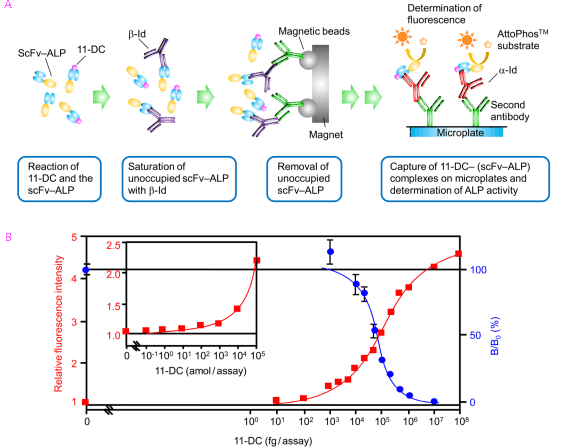
■−■ は非競合型酵素免疫測定法の、●−● は比較のため行った競合型ラジオイムノアッセイの用量作用曲線。
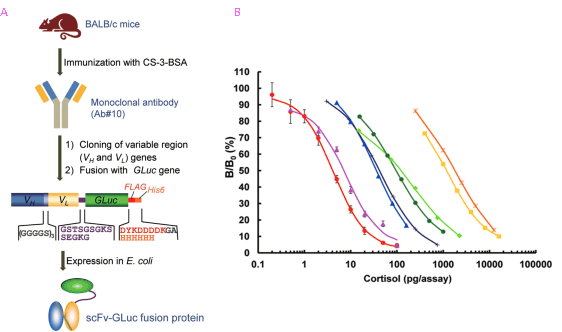
免疫測定法では、酵素や蛍光色素などで標識した抗原あるいは抗体を抗原抗体反応の進行を知るためのプローブとして用います。従来は、両者を化学反応により連結していましたが、反応モル比の制御や未反応の試薬の除去に限界があり、このことが測定感度を低下させる一因となっていました。いまでは、遺伝子操作により、異なる機能を持つ2つ以上のタンパク質を直結させた「融合タンパク質」を作製することができます。我々は、分析対象の低分子抗原に結合するscFvを、生物発光酵素、Gaussiaルシフェラーゼ (海洋性カイアシ由来の発光酵素) (GLuc) と連結させた融合タンパク質を作製して、免疫測定法に活用しました。scFvと酵素がモル比1:1で結合した、理想的な「酵素標識抗体」です。これを用いたコルチゾール (副腎皮質ステロイド) の「生物発光ELISA」では、既存のコルチゾール免疫測定キットに比べて大幅に高い感度が得られています (図5)。
図5. scFv-GLuc融合タンパク質の作製 (A) とコルチゾール免疫測定法の用量作用曲線 (B)
(B)
●:当研究室の生物発光ELISA
▲:当研究室のscFv-ALP-ELISA
▲:DetectX (ArborAssays)
●:Cortisol ELISA kit (Enzo Life Sciences, inc.)
◆:Cortisol ELISA kit KA4009 (Abnova)
*:Cortisol AccuBind ELISA Kits (Monobind inc.)
+:Cortisol EIA Kit Expanded Range High Sensitivity Salivary (SALIMETRICS)
■:DRG Cortisol ELISA EIA-1887 (DRG International Inc.)
横軸のコルチゾール用量は、各測定キットに添付された情報を基に、ng/mLまたは mg/dL単位からpg/assay単位に換算した。
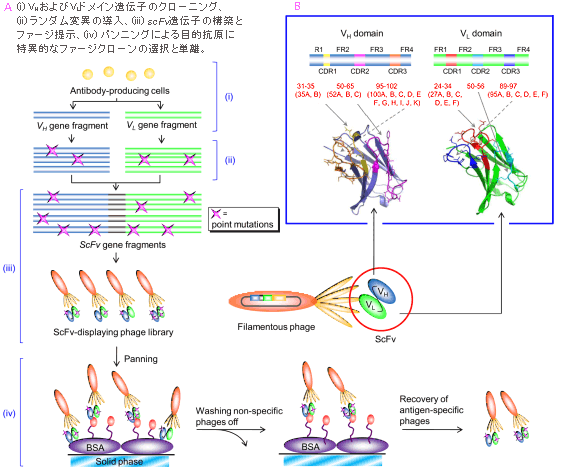
分析試薬として利用される抗体は、現在、ほとんどB細胞ハイブリドーマ法により調製されています。しかし、動物の免疫応答は遺伝的統御を受けるため、得られる抗体の機能(抗原への親和性や特異性など)にはおのずと限界があります。我々は、進化分子工学の手法による抗体機能の改善に取り組んできました。抗体可変部遺伝子へin vitroでランダム変異を導入することにより変異抗体の分子集団 (ライブラリー) を構築し、より優れた機能を獲得した分子種を選択するもので(図6)、いわば「抗体の育種」です。
図6. ファージ提示法を活用した進化分子工学による改良型抗体フラグメント (一本鎖FVフラグメント) の
創製プロセス (A) と抗体可変部ドメイン (VHとVL) の構造 (B)
すでに複数の低分子バイオマーカーについて、「試験管内親和性成熟」に成功し、得られた変異体を用いて免疫測定法 (ELISA) の高感度化に成功しています。エストラジオール-17β (卵胞ホルモン) と結合するマウス由来の抗体のH鎖可変部 (VH) とL鎖可変部 (VL) を遺伝子操作により連結して「一本鎖Fvフラグメント」(single-chain Fv fragment; scFv) を作製し、その遺伝子に3段階の点変異導入を行ったところ (図7A)、得られた変異体のひとつはマウス抗体のFabフラグメントより250倍大きな親和性を示し、約40倍高感度な ELISAが可能になりました (図7B)。この成果を発表した論文のひとつは、Analytical Chemistry誌のウェブサイトで、ハイライト論文に選ばれました。また、受動喫煙マーカーであるコチニン (ニコチンの主代謝物) に特異的なscFvを作製し、一回の変異導入で40倍以上も親和力が向上した変異体を創製しました (図7C)。この変異体を用いることで、ELISAを100倍も高感度化することに成功し (図7D)、受動喫煙レベルのヒト尿中コチニン測定が可能になりました。マウスB細胞レパートリーの限界か、従来のハイブリドーマ法では実用的な抗コチニン抗体を得ることは極めて困難でした。我々の成果は、遺伝子操作による「抗体育種」が免疫測定法を抜本的に改善しうる方略であることを実証したものであり、その意義は大と考えています。
図7. 「抗体育種」による免疫測定法の高感度化 改良型抗エストラジオール-17β scFvの一次構造 (A)とELISAへの応用 (B)、ならびに改良型抗コチニン scFvの一次構造(C)とELISAへの応用(D)
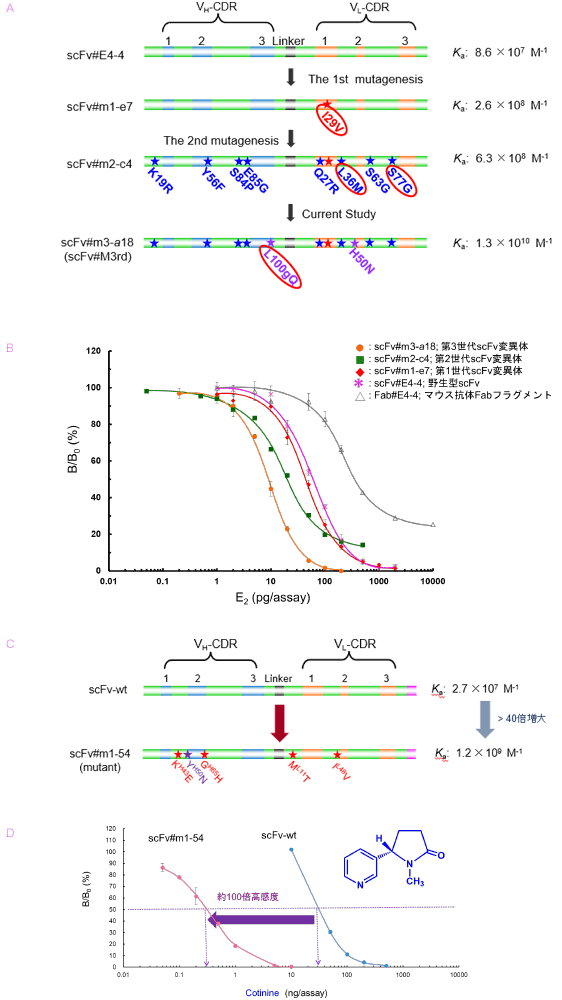
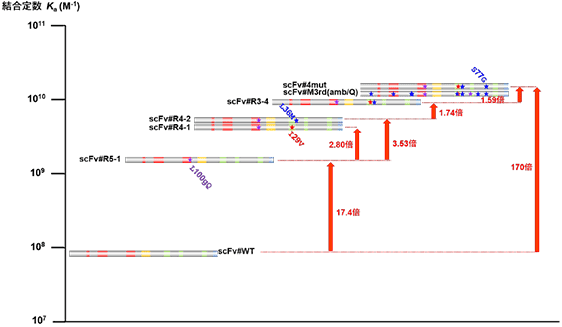
ところで、上記の改良型抗エストラジオール-17βscFvには、計11カ所ものアミノ酸置換が認められています。 我々は各置換の効果を系統的に調べ、親和力の向上は主に4カ所の置換(図7A:赤〇で囲んだもの) が担うことをつきとめました。実際、これら4つの置換のみを導入した変異体scFv#4mutを作製したところ、scFv#m3-a18 (scFv#M3rd) と同等のKaを示しました(図8)。なかでも、VHの相補性決定部 (complementarity-determining region; CDR) 3におけるL100gQ (VH 100g 番のアミノ酸がLeuからGlnに変化) の置換が重要で、この置換のみを導入したscFv#R5-1はscFv#4-4より17.4倍大きいKaを示しました(図8)。VHとVLに3カ所ずつ存在するCDR (N 末端側から1、2、3と呼ぶ) が抗原との相互作用に重要な役割を演じることを考慮すれば、頷ける結果です。
図8. 抗エストラジオール-17β scFvの親和性成熟過程の解析
図7Aに示した4つのアミノ酸置換の親和力増強の効果は L100gQ (VH) >> L36M (VL) ≥ I29V (VL) > S77G (VL) であり、これらは相加的である。
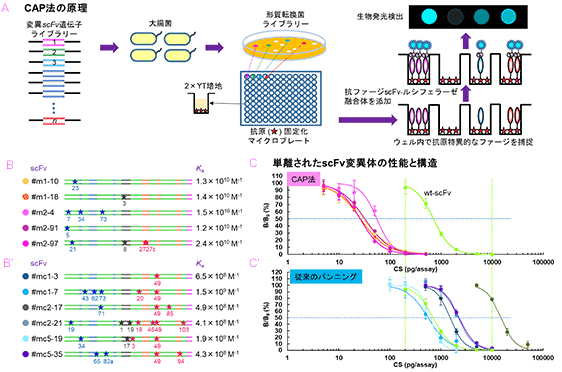
上述のように、変異抗体ライブラリーを作製・探索することで、より優れた抗原結合能を持つ変異体を得ることが可能と期待されます。希少な改良型変異体の単離には、図6A(iv) の「パンニング」 (固定化抗原に対するアフィニティー抽出) が常法とされています。しかし、現実には、期待するような変異体が得られず、「そもそもライブラリー中に存在しないのか、あるいは存在するが釣れないのか」、と悩むことがしばしばです。我々は、「後者のケースが少なくないのでは?」、と疑り続けてきました。限られた量の固定化抗原に対して、ごく少数の改良型変異体が大過剰の改悪型変異体や未変化体と競合的に反応するのですから、淘汰されて然るべし、です。そこで、その解決法として 「クローンアレイプロファイリング (clonal array profiling; CAP) 法」 を開発しました(図9A)。変異抗体遺伝子で形質転換した大腸菌コロニーから産生されるモノクローナルファージを、マイクロプレートを用いてプロファイリングするものです。各ウェル内で産生される微量のscFv提示ファージは、その抗原親和力に応じて予めプレートに固定化された抗原に捕捉され、我々が作製した抗ファージscFv-GLuc融合体により生物発光検出されます。試みに、コルチゾールに対する変異scFvライブラリーを作製し、その3%をCAP法に付しました。対照実験として同一ライブラリーの100%を従来のパンニング (3種のプロトコールによる多重試験を実施) に付しましたが、 CAP法による変異体が明らかに優れていました。すなわち、わずか2回の試行で, その結合定数Kaが1010を上回る高親和力変異scFvが一挙に計5種も得られました。野生型scFvのKaは3.8×108 (M−1) ですが、32-63倍の改善です。これに対してパンニングで得られた変異体の改善は最大でも5倍に過ぎず、しかも両方法で得られたscFvクローンにはその一次構造に共通性は全く見られませんでした (図9B)。CAP法由来のscFvを用いてコルチゾールの競合ELISAを行ったところ、大幅な高感度化 (50%置換値で11-25倍) が達成されましたが、パンニングにより得られた変異体のもたらす感度の上昇は、当然ながら評価に耐えないものでした(図9C)。以上のように、CAP法の有用性と戦略の妥当性が示されました。我々は 「抗体育種」 の真の実力を開花させる決定打になるものと期待しています。なお、CAP法は将来の自動化を前提としてデザインしており、よりハイスループットな変法も鋭意開発中です。成功すれば、106を超えるサイズのライブラリーの全クローンを網羅的に解析することも可能で、さらに 「違った世界」 が見えてくるでしょう。
図9. ハイスループットな高性能変異抗体の創出を目指すクローンアレイプロファイリング (CAP) 法
CAP法の原理(A)、単離された抗コルチゾール変異scFvの一次構造と結合定数(B)、および単離された抗コルチゾール変異scFvを用いるELISAの感度 (C)。対照実験としてのパンニングで得られたscFvの一次構造と結合定数(B’) (B’)とELISAにおける感度 (C’)を併せて示す。
抗体の抗原結合部位 (パラトープ) を形成する可変部ドメイン、VHとVLは、いずれも相補性決定部 (CDR; 上記) と枠組み領域 (framework region; FR) が交互に現れるモザイク様構造 (N末端から、FR1→CDR1→FR2→CDR2→FR3→CDR3→FR4) を持ちます (図10A)。CDRは上述のようにループ構造を形成して抗体分子の表面に露出し、抗原と接触して相互作用します (図10B)。なかでもVHのCDR3は抗体間でのアミノ酸配列の変化が激しく、抗体が抗原に対して特異性と親和力を発揮するうえで最も重要な部分構造と考えられてきました。それゆえ、抗体工学の黎明期には、抗原結合能の改善を目的とする変異の導入は、その多くがVH-CDR3を標的とするものでした。一方、FRはβ-シート構造を形成してCDRループを支える土台を形成します (図10B)。抗原と直接相互作用することは考えにくいため、意図的に変異が導入されることはほとんどありませんでした。ところが、我々は上記CAP法の開発過程で、4つのFRのうち、N末端1-30番アミノ酸で構成されるFR1 (図10A,B) が変異の標的部位として有望であることを発見しました。すなわち、 図9Bに示したCAP法由来の高親和力scFv変異体5種のうち、#m1-18を除く4種についてFR1内にアミノ酸置換が認められ、しかも、変異体#m1-10と#m2-91では、scFv全長のうちFR1内のわずか1カ所の置換のみで、コルチゾールに対する結合定数Kaが野生型scFv にくらべて30倍以上も増大しています。また、このとき同時にVHの6番と7番のアミノ酸の間に1残基のアミノ酸 (グルタミン) が挿入された変異体 (#m1-2) が見つかっています。この変異体も25倍以上高いKa値を示しました。そこで、FR1の配列をランダム化した2種の抗コルチゾールscFvライブラリー (a、b) を新たに作製しました。ライブラリーaはN末端1-3、5-7、9、10番アミノ酸に小規模なランダム化を施したもの、ライブラリーbは6番と7番の間に連続する1-6残基の完全ランダム化アミノ酸 (NNSコドンによる) を挿入したものです (図10C)。これらのライブラリーに含まれうる高親和力変異体をCAP法で探索したところ、Kaが約15-30倍向上した変異体をライブラリーaから7種、bから14種も得ることができました (図11)。CAP法の選択効率ゆえの成績です。ライブラリーbからは、わずか1アミノ酸の挿入で25倍以上も高いKaを示す変異体が4種も得られ、このうちmB1-3#4は、このFR1ライブラリー作製の動機のひとつとなった変異体#m1-2 (前述) と同一の分子種でした。これらのうち、1010(M−1) レベルのKaを示した7種のscFvは、ELISAにおいて野生型scFvより約8.3-24倍も高い感度を与えました (50%阻害値の比較) (図12)。FR1が変異標的部位として有効であることを示す初めての成果で、現在、特許を申請中です。
図10. 野生型抗コルチゾールscFvに組み込まれた VHおよびVLドメインのFR/CDRモザイク構造(A) 、同scFvにおけるFR1の立体構造(B) 、およびFR1配列に変異を導入した抗コルチゾールscFvライブラリー (aおよびb) の
構成(C)
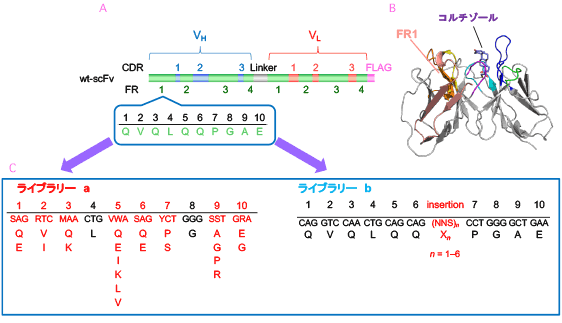
図11. FR1配列をランダム化した抗コルチゾールscFvライブラリー (aおよびb) から得られた高親和力scFv変異体の一次構造および結合定数Ka
ライブラリーa 由来の変異体については1~10番のアミノ酸配列を、ライブラリーb由来の変異体については1~7番のアミノ酸配列を示す。
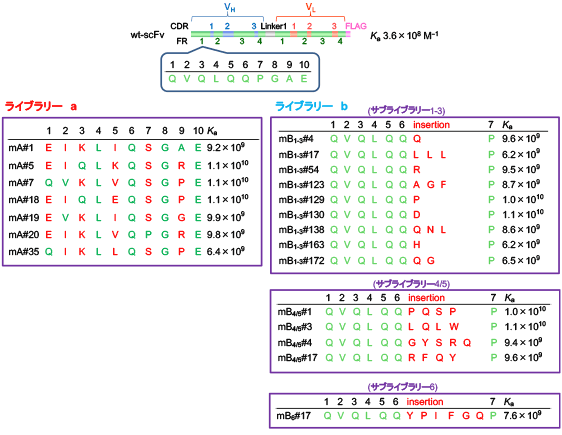
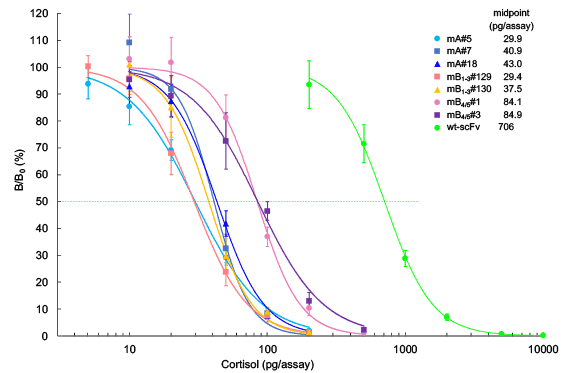
図12.高親和力scFv変異体を用いたコルチゾールELISAの用量作用曲線
前述のとおりCDRは抗原認識に重要な役割を演じますが、なかでもVHの CDR3 (VH-CDR3) はアミノ酸の配列と長さの変化が激しく、抗体の分子認識パターンを決定づける場合が多いと考えられています。それゆえ、抗体工学の黎明期には、VH-CDR3を構成するアミノ酸 (マウス抗体では1~19残基の範囲) を集中的にランダム化したライブラリーを構築して、新たな特異性を獲得した、あるいは親和力の上昇した変異体を探索する研究が盛んでした。しかし、特定の抗原に対して産生された天然抗体は、莫大なバリエーションのなかから高度に最適化されたVH-CDR3を備えているため、この部位を人為的に改変した変異体のほとんどはむしろ機能が低下し、特に親和力成熟の成功例は極めて限られます。このため、VH-CDR3選択的な変異導入は、理論的には「機能改善への王道」でありながら、最近では敬遠される傾向にありました。
我々は、上記のCAP法の探索能力に期待し、VH-CDR3選択的な変異導入による親和性成熟に挑戦しました。上記のエストラジオール-17β に特異的な野生型 scFv (scFv#E4-4; Ka = 8.6 × 107 M−1) をとりあげ、まずVH-CDR3を構成するアミノ酸のうち13残基 (95-100g 番) について、そのいずれかを完全ランダム化した13種のミニライブラリー (lib-s1~s13) を作製してCAP法に付し、最も親和力に優れる1置換変異体を探索しました (図13A)。その結果、先のランダム点変異導入による研究で「偶然」発見したL100gQの置換が最も有効であることが判明しました。ついでH99Pの置換が有効で、Kaを6.9倍高めました (図13B)。さらに、連続する3つのアミノ酸 (例えば95・96・97番) を完全ランダム化した11種のミニライブラリーを作製し、CAP法で探索したところ、35倍高いKaを示す3置換変異体 scFv#m3を発見しました。この変異体はやはりL100gQの置換を持ち、100e 番と100f 番はそれぞれN (Asn)、A (Ala) に置換されていました。
そこで、この3連続の置換と上記の H99P 置換を併せ持つ4置換体scFv#m4を作製したところ、協奏効果によりKaは野生型の90倍 (7.7 × 109 M−1) まで増大しました (図13B)。このscFv#m4のVLドメインに先に見出した親和力の増大に寄与する3つの置換 (I29V、L36M、S77G) (図7A) を加えた7置換体scFv#m7を作製したところ、VLドメインの置換とVH-CDR3内の置換はやはり協奏的に作用し、Ka = 3.2× 1010 M−1)の高い親和力を発揮しました (図13B)。野生型のscFv#E4-4からスタートして、Kaを372倍も高めたことになりますが、これはステロイド類に対する抗体の試験管内親和性成熟として最高の改善倍率です。scFv#m7 を用いたELISAは極めて高感度で、検量線の50%阻害値は4.46 pg/assayでした。この成果を報告した論文は、Biological Pharmaceutical Bulletin 誌にてFeatured articlesに選ばれました。
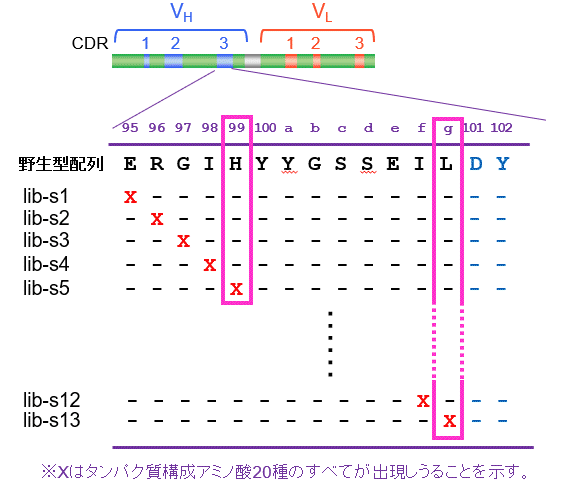
図13A. VH-CDR3を標的とする1置換高親和力scFvの探索
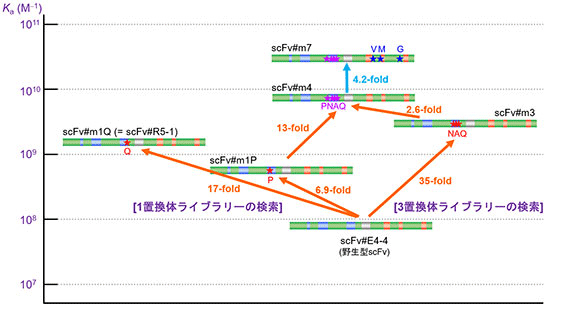
図13B. VH-CDR3への変異導入を鍵とする高親和力scFvの創製

